Absorbție vs. adsorbție

Conţinut
- Cuprins: diferență între absorbție și adsorbție
- Ce este Absorbția?
- Ce este adsorbția?
- Diferențele cheie
Principala diferență între absorbție și adsorbție este, absorbția este procesul în care lichidul este dizolvat fie solid, fie lichid. Dimpotrivă, adsorbția este procesul în care ionii, moleculele sau atomii dintr-o substanță precum gazul, solidul sau lichidul, aderă la suprafața adsorbantului.
Cuprins: diferență între absorbție și adsorbție
- Ce este Absorbția?
- Ce este adsorbția?
- Diferențele cheie
- Explicație video
Ce este Absorbția?
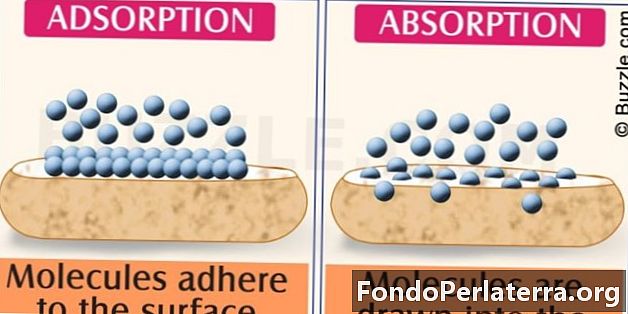
Absorbția este un proces în care o substanță intră complet în altă substanță. Este un proces în care un atom sau moleculă este aspirat în interiorul unui volum de alte molecule. Trebuie să fie o parte a substanței, intrând complet în ea. Ar putea fi un proces chimic sau fizic. De exemplu, dioxidul de carbon ar putea fi absorbit în soluția de carbonat de potasiu. Acesta este un exemplu de absorbție chimică, deoarece are loc o reacție. Un alt exemplu ar putea fi dizolvarea aerului în interiorul apei. Aceasta este absorbția fizică, deoarece aerul intră în apă prin presiune de echilibru. Când orice substanță sau material îmbibă o anumită cantitate de lichid sau gaz în interior, se spune că acel material a absorbit celălalt material. Prin urmare, în absorbție, ceva se mișcă în interiorul unui material.
Ce este adsorbția?
Adsorbția este procesul în care gazul sau lichidul nu sunt absorbite, dar se formează numai la suprafață. Din motive sintetice și de purificare a apei, fenomenul de adsorbție este utilizat pe scară largă în industrii. Implică adeziunea. O substanță doar se agață de cealaltă substanță din acest proces, fără a intra în ea. De exemplu, dioxidul de carbon se află pe suprafața adsorbantului din interiorul unității adsorbante cu balansare sub presiune. Acesta se așează pe suprafața adsorbantului solid.
Diferențele cheie
- Asimilarea speciilor moleculare în cea mai mare parte a solidului sau lichidului este denumită absorbție. Acumularea speciilor moleculare la suprafață și care nu intră în ea este denumită adsorbție.
- Absorbția este un fenomen major, în timp ce adsorbția este un fenomen de suprafață.
- Absorbția este un proces endotermic, în timp ce adsorbția este un proces exotermic.
- Absorbția nu este afectată de temperatură și adsorbția este favorizată de temperatura scăzută.
- Absorbția are loc la o rată uniformă, în timp ce rata adsorbției crește constant, apoi ajunge în cele din urmă la echilibru.
- Concentrația este absorbția este aceeași pe întregul material. Concentrația la suprafață este diferită în adsorbție față de cea din cea mai mare parte.
- Absorbția este utilizată comercial în răcitoare și în epurarea apei.
- Absorbția este legată de volum, în timp ce adsorbția este legată de suprafață.
- Absorbția implică dizolvarea și difuzarea în timp ce adsorbția implică aderența.
- În absorbție, energia unui foton este absorbită de o altă entitate.